機械設計者に必要な熱力学の知識と計算能力を身につけられる!エンタルピ、エントロピ、エクセルギといった重要な概念を深く理解し、具体的なサイクルと共に設計に応用する力を養える。
モルとアボガドロ数
モルとは
「モル」とは原子や分子の単位のことです。原子や分子はご存知のとおり、とても小さいですがちゃんと重さを持っています。しかし、1個単位では測定ができません。そのため「モル」という単位が誕生しました。
原子や分子 6.02×1023個 = 1モル とした。
602000000000000000000000 個 = 1モル
鉛筆12本を1ダースとしたのと同じです。
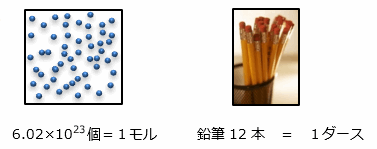
そして、このかたまりのことを世界共通の基準として アボガドロ数 としました。
アボガドロ数 NA = 6.02×1023 [mol-1]
従って、1モルの気体に含まれる分子の数は、気体の種類に関係なく一定の6.02×1023 となります。(1ダースに含まれる鉛筆の本数は鉛筆の種類に関係なく12本です。)
状態方程式 PV=nRT より
P :大気圧 1.013×105Pa
V :体積 100L = 0.1m3
R :気体定数 8.31 J/(K・mol)
T :温度273K (0℃)
モル数 n = PV/RT
= (1.013×105×0.1)/(8.31×273) = 4.46 mol
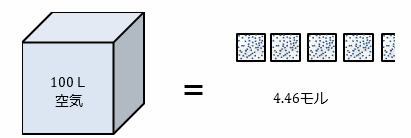
従って、1mol = 100 / 4.46 = 22.4 L より、
標準状態(1気圧、0℃)では 1mol = 22.4 L となります。
また、100Lの空気に含まれる分子の数 n は
n = 4.46 × 6.02×1023 = 2.68×1024 個 となります。
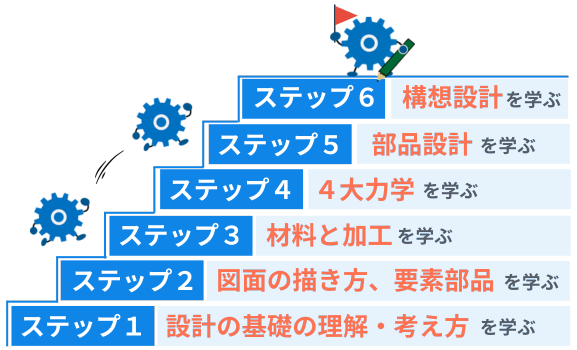
独自開発されたMONO塾の「ステップ式学習プログラム」<法人採用実績:700社以上>
カテゴリーメニュー
スポンサード リンク