機械設計者に必要な熱力学の知識と計算能力を身につけられる!エンタルピ、エントロピ、エクセルギといった重要な概念を深く理解し、具体的なサイクルと共に設計に応用する力を養える。
ボイル・シャルルの法則と状態方程式について
ボイル・シャルルの法則
気体の 圧力(P) と 温度(T) と 体積(V) は次の関係があります。
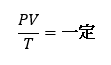
これを 「ボイル・シャルルの法則」 といいます。
ボイル・シャルルの法則は、「ボイルの法則」 と 「シャルルの法則」を合わせた法則ですので、次にそれぞれについて解説します。
ボイルの法則
ボイルの法則を理解して頂くために、針のない注射器を事例に説明します。針のない注射器に栓をした状態で、ピストンを押し込むと内部の体積が減少して圧力が上昇します。
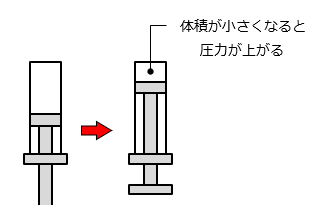
圧力が上昇する理由は、体積が減少することで空気の中の分子が壁にぶつかったり、分子同士でぶつかったりする回数が増えるからです。
このように温度が一定の場合、
体積が減少すると圧力が上昇、
逆に、体積が増加すると圧力が減少するように、
体積(V)と圧力(P)が反比例の関係になる法則が 「ボイルの法則」 です。
シャルルの法則
次にシャルルの法則ですが、例えば鍋にふたをして加熱すると鍋のふたが持ち上がります。これは温度が上がることで、鍋の中の原子や分子が激しく動くことで空気が膨張し体積が増えるからです。
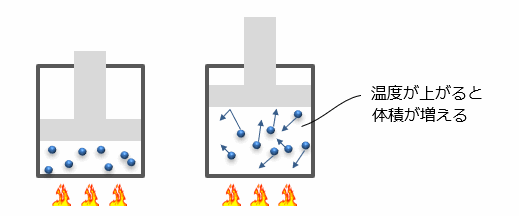
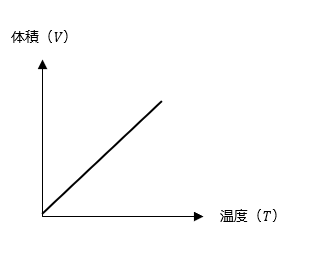
このように圧力が一定の場合、温度(T)が上がると、体積(V)が増加し、また逆に温度(T)が下がると、体積(V)が減少するように温度(T)と体積(V)が比例関係になる法則を 「シャルルの法則」 といいます。
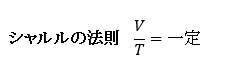
この 「ボイルの法則」 と 「シャルルの法則」 を合わせたものが 「ボイル・シャルルの法則」 です。
理想気体における状態方程式
ボイル・シャルルの法則は実在する気体では成立せず、理想気体において成立します。
理想気体とは?
理想気体とは、分子の体積がゼロであり、分子間力が働かない実在しない気体のことです。
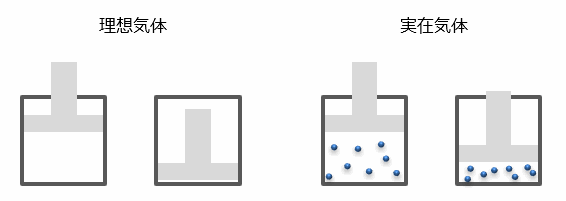
理想気体は -273℃ (0K) になっても 液体 や 固体 になりません。
一方、実在する気体は冷やしていくと 液体 や 固体 になります。
例えば窒素は -195℃ で液体窒素になります。
理想気体のような気体は実在しませんが、空気、窒素、水素などの気体は、常温、常圧では理想気体として扱うことができます。
なぜなら、圧力が低い場合は分子を無視することができるからです。
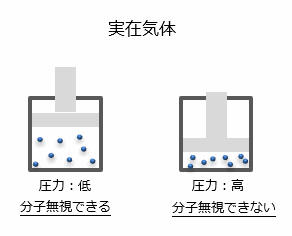
この理想気体において、「圧力」・「体積」・「温度」の三つの要素間で一定の関係があります。このうち2つの要素が決まれば残りの1つの要素は必然的に決定されます。
これらの関係を数式にしたものが 「状態方程式」 です。
理想気体の質量が m [kg] の状態方程式は、ボイルシャルルの法則より、
PV/T = 一定 であり、
気体の質量 m と 気体定数 R をかけたものと一定となるため
PV/T = mR となります。
式を変形して、
P : 圧力
V : 体積
m : 質量
R : 気体定数
T : 温度
気体定数Rはガス定数とも呼ばれ、単位は J/(kg・K) です。
Rは以下の表に示すとおり、気体によって異なる定数です。
| 気体の種類 | 気体定数 R J/(kg・K) |
|---|---|
| 二酸化炭素 | 188.9 |
| 酸素 | 259.8 |
| 窒素 | 296.8 |
| 水素 | 4124.6 |
| 空気 | 287.0 |
因みに化学では、状態方程式を質量 m[kg] ではなく「モル数」で表現します。(※「モル」については後程に詳しく解説します。) 状態方程式をこのモル数で表現すると、
PV = nR0T で表されます。
1モルの気体は標準状態で 22.4L です。
(化学の一般常識 詳細は 「モルとアボガドロ数」を参照ください。)
標準状態とは 0℃、1気圧( 1.013×105Pa ) の状態です。
これを状態方程式に代入すると、R0 を求めることができます。
R0 = PV/nT = (1.013×105×22.4) /( 1×273)
= 8.31*103 [(Pa・L)/(K・mol)]
= 8.31 [J/(K・mol)]
R0 は一般気体定数といい、気体の種類に依存しない定数です。
P : 圧力
V : 体積
n : 分子数
R0: 一般気体定数
T : 温度
独自開発されたMONO塾の「ステップ式学習プログラム」<法人採用実績:700社以上>
カテゴリーメニュー
スポンサード リンク