熱力学の基礎を学べるeラーニング販売中!
機械設計者に必要な熱力学の知識と計算能力を身につけられる!エンタルピ、エントロピ、エクセルギといった重要な概念を深く理解し、具体的なサイクルと共に設計に応用する力を養える。
熱力学第一法則
熱力学第一法則は次の式で表されます。Q = ΔU + W
Q は加えた熱量
ΔU は内部エネルギーの増加量
W は行った仕事です。
式だけ見ても良くわかりませんので具体的な例で説明します。
下図のように ピストンを固定した状態 で、シリンダーを熱量(Q)で加熱します。
すると内部の気体の温度が上昇して、圧力が上昇します。
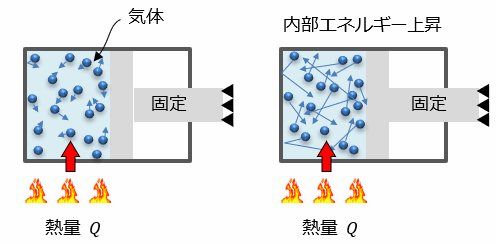
この場合、加えた熱量(Q)は全て温度の上昇「=内部エネルギーの上昇(気体の場合)」に変化します。
従って、これを式にすると、
Q = ΔU となります。
次にピストンを固定せずに熱量(Q)を加えてみます。
すると内部の分子の運動が激しくなることで温度が上昇して、空気が膨張しピストンが移動します。
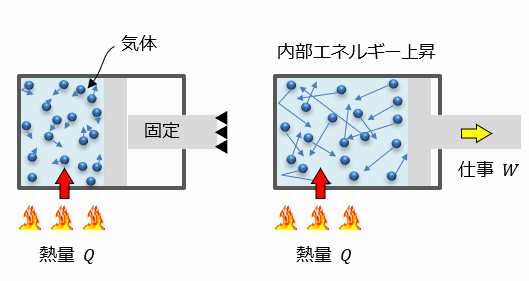
つまり、内部の気体が 「外部に対して仕事を行った」 ということです。
ここで、ピストンは大気の圧力(P)とバランスを取りながら移動するため、内部圧力は常に一定となります。このときの仕事Wは圧力が一定であるため、
W = PΔV となります。(※詳しくは仕事とエネルギーで解説)
従って、加えた熱量(Q)が内部エネルギーの上昇(ΔU)とピストンを動かすという仕事(W)に変換されたということになり、
Q = ΔU + W
= ΔU + PΔV
が成り立ちます。
熱と仕事は同じものであり、「熱から仕事へ」、「仕事から熱へ」 変換することができ、その間においてはエネルギーが保存されます。
これを 熱力学第一法則 といいます。
内部エネルギーとは
ここで内部エネルギーについてもう少し理解を深めます。
内部エネルギーとは、物体内部に持っているエネルギーのことです。
物体内部のエネルギーとは、
1.分子の運動によるエネルギー
2.分子間で働く力によるエネルギー
です。
この2つのエネルギーを合わせて 内部エネルギー といいます。
分子は熱を受けることで激しく運動を行います。
固体と液体は、分子間で働く位置エネルギーを持っています。
しかし、気体では分子間で働く位置エネルギーを無視することができます。
気体は、「分子間で働く位置エネルギー」 を無視することができます。
前の項目で解説したピストンの例は、熱を受けたのは「気体」でしたので、「分子間で働く位置エネルギー」 を無視することができます。従って、ピストンのケースでは、 内部エネルギー(ΔU) = 分子の熱運動による運動エネルギー となります。
\ 機械設計者向け「eラーニング」でスキルアップ! /
独自開発されたMONO塾の「ステップ式学習プログラム」<法人採用実績:700社以上>
当サイトの記事は、無料会員登録をすることでPDFファイルで読むことができます。また、印刷することも可能です。設計者に必要となる製図、材料力学、機械要素など全部で18種類のテキストを無料でダウンロードしていただけます。
ダウンロードの詳細はこちらからご確認ください。
カテゴリーメニュー
スポンサード リンク